Precisiegeneeskunde bij epilepsie
Het programma wordt mogelijk gemaakt door een prachtige donatie van ouders van twee kinderen met epilepsie. Het programma bouwt verder op het werk dat de afgelopen jaren door deze onderzoekers en hun teams is verricht, mede mogelijk gemaakt door een eerdere donatie van deze ouders in 2015. Beide donaties worden in de vorm van het zogenaamde MING-fonds beheerd door de Stichting Vrienden van het UMC Utrecht. Het epilepsieonderzoek wordt in het UMC Utrecht uitgevoerd door het Hersencentrum (speerpunt Brain).

Het UMC Utrecht is een door de NFU en Orphanet erkend landelijk expertisecentrum voor zeldzame kinderepilepsie (in het bijzonder epilepsiechirurgie, epilepsiegenetica, tubereuze sclerose en ESES/CSWS). Het is het enige Nederlandse centrum dat onderdeel uitmaakt van het ERN (European Reference Network) EpiCARE, een consortium van 28 Europese centra uit dertien landen met specifieke expertise op het gebied van zeldzame en complexe vormen van epilepsie.
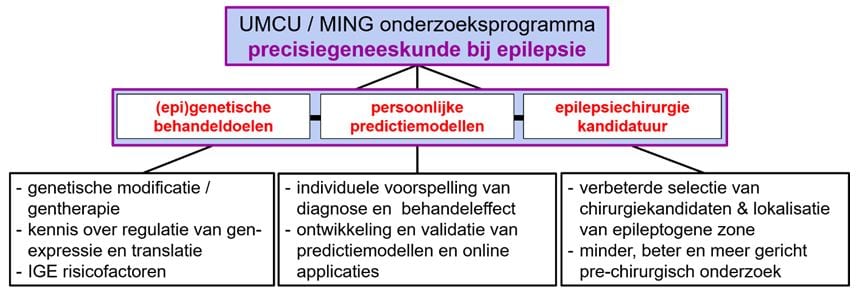
Precisiegeneeskunde bij de behandeling van epilepsie
Precisiegeneeskunde gaat uit van een individuele benadering van een patiënt, waarbij rekening wordt gehouden met de grote variabiliteit in genetische factoren, ziektekenmerken, en omgevingsfactoren. Het is een vorm van personalized medicine, oftewel therapie op maat. Binnen de epileptologie is lang uitgegaan van een one size fits all-benadering; patiënten van alle leeftijden en met zeer uitlopende oorzaken en verschijningsvormen van epilepsie krijgen daarbij anti-epileptica met een breed werkingsmechanisme (zoals valproaat en levetiracetam). Anti-epileptica voorkomen aanvallen, maar hebben geen invloed op het uiteindelijke beloop van de epilepsie of de oorzaak ervan.